Управление по контролю качества пищевых продуктов и лекарственных средств при министерстве здравоохранения и социальных служб США (FDA) распорядилось о дополнительной проверке эффективности действия имплантов височно-нижнечелюстного сустава после выявления значительного числа осложнений, накопившихся при использовании этих устройств за последние несколько лет.
Лишь за несколько месяцев до этого изданиеMilwaukeeJournalSentinel/MedPageToday провело журналистское расследование, которое показало, что FDA разрешило к употреблению четыре модели таких искусственных суставов, первую – ещё в 1999 году, несмотря на то, что подготовка к сертификации велась на слабой исследовательской базе, результаты исследований были неполными, к тому же процесс выдачи разрешений на эксплуатацию этих имплантов был скрыт в тумане потенциального конфликта интересов.
Объявив о своём нынешнем решении, FDA заявило, что обнаружило значительное количество инцидентов с имплантами в период с 2004 по 2010 годы. В некоторых случаях импланты, установленные пациентам, причиняли последним такую боль, что устройства приходилось досрочно удалять.
В электронном письме, которое FDA направила редакцииJournalSentinel/MedPageToday, сообщается, что результаты исследования извлечённых из пациентов имплантов показали: 52% этих устройств пришлось извлечь менее чем через три года после имплантации. Это значит, что их пришлосьдемонтировать досрочно, поскольку их минимально установленный срок службы составляет пять лет.
Неизвестно, сколько пациентов установили себе эти импланты, первый из которых был разрешён к установке в 1999 году, но полагают, что их тысячи.
«Это решение было принято FDAслишком поздно», — сказал Терри Коули, президент расположенной в городе Брукфилд (штат Массачусетс) организации по защите прав пациентов, страдающих заболеваниями височно-нижнечелюстных суставов. «Первым приоритетом производителей и FDA должна стать безопасность пациентов, получающих эти импланты», — добавил он.
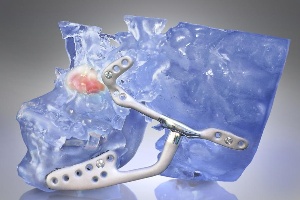
Последнее решение FDA распространяется на импланты, предназначенные для лечения расстройства височно-нижнечелюстного сустава – группы заболеваний, влияющих на сочленение, соединяющее нижнюю челюсть с головой.
Такими расстройствами страдают более 10млн американцев. Небольшая часть из них вынуждена подвергаться радикальному хирургическому вмешательству для имплантации искусственного челюстного сустава.
По сообщению FDA, дополнительное исследование показало наличие таких проблем, как ослабление искусственных суставов, затруднения при их извлечении, производимый ими шум, наличие трещин и изломов.
Помимо симптомов, связанных с первоначальными операциями и с операциями по удалению имплантов, пациенты сообщали о ряде негативных явлений, включающих боль, необходимость прохождения дополнительного курса лечения, госпитализации, потребность в нехирургических видах лечения или приёме лекарственных препаратов, инфекцию, набухание и головную боль.
«Преждевременно обсуждать, следует ли снимать какие-либо из этих устройств с продажи», — сообщила в электронном письме представительница FDA Эрика Джефферсон. «Мы оценим данные, которые к нам поступают, и после этого можем принять дальнейшие регуляторные меры», — добавила она.
Начиная с 1999 года FDA одобрила четыре модели таких устройств, выпускаемых тремя компаниями. При одобрении моделей к производству власти потребовали от производителей собрать данные об опыте употребления клиентами их продукции.
Эти данные не были исчерпывающими, сообщила FDA, отметив, что, в частности, отсутствует информация о причинах и скорости замены имплантов. Кроме того, производители утратили координаты многих пациентов, которые получили их продукцию.
Не обладая вышеуказанными сведениями, FDA не может сделать достоверного вывода о безопасности и эффективности этой продукции и о том, следует ли снять какие-либо из них с продажи.
«Решение очень и очень запоздавшее», — заявила Диана Цукерман, президент Национального исследовательского центра женщин и семьи. «Но важно, что они наконец озаботились этим вопросом. Проблема существует с 1999 года, но руководящие лица сменились, и, надеемся, что-то всё-таки будет сделано», — добавила она.
Цукерман особенно отметила то, что FDA признала факт утраты производителями имплантов связи с потребителями этих устройств.
При исследовании результатов клинических испытаний, которыми воспользовались для сертификации этих имплантов, издание JournalSentinel/MedPageToday выявило ту же проблему: многие пациенты прервали участие в испытаниях, поэтому недоставало сведений о продолжительном ношении имплантов – так, при испытаниях одной из моделей имплантов только 34% пациентов предоставили сведения об особенностях ношения этих устройств в течение трёх лет.
Цукерман задалась вопросом, наберётся ли хотя бы в этот раз FDA решимости потребовать долговременного отслеживания информации о пациентах, пробующих носить импланты. «Если производители не могут собирать информацию о своих пациентах, но FDA, несмотря на это, разрешает производство таких имплантов, тогда не приходится удивляться, что фирмы не воспринимают всерьёз вопросы качества своей продукции», — сказала она. «Нет доказательств, что эти устройства безопасны и эффективны. И мы надеемся, что сейчас наблюдаем новый признак настоящего принуждения производителей к соблюдению требований качества», — добавила она. Цукерман считает, что в этом есть заслуга издания JournalSentinel/MedPageToday, поскольку опубликованные в нём статьи подтолкнули FDA к действиям.
Американский сенатор-демократ от штата Висконсин Хёрб Коль, председатель специального комитета Сената по делам старения, сказал, что будет пристально наблюдать за действиями FDA и в этом году может созвать слушания на тему качества имплантов височно-нижнечелюстных суставов и других предметов медицинского назначения.
«Побуждение FDA к назначению дополнительного исследования качества устройств, заменяющих височно-нижнечелюстные суставы – это шаг в правильном направлении и это единственный способ определить, работают ли эти устройства в соответствии со своим назначением или отказывают, вызывая мучительную боль, которой можно было бы избежать», — говорится в заявлении Коля.
Расследование, которое провёл JournalSentinel/MedPageToday, выявило, что процесс выдачи разрешений на производство имплантов характеризовался не только недостаточной строгостью, но и очевидной пристрастностью в пользу производителей медицинского оборудования.
Например, хотя комиссия экспертов и сотрудники FDAвысказывали серьёзную обеспокоенность, несмотря на это, консультативные группы FDA всё же единогласно проголосовали за одобрение представленных образцов имплантов в трёх случаях из четырёх. В четвёртом же случае консультативная группа проголосовала против одобрения, но вышестоящее руководство FDA всё же одобрила имплант несколько месяцев спустя.
Три производителя, а именно компании TMJSolutions, TMJMedical и BiometMicrofixation, изготавливают в настоящее время импланты, заменяющие височно-нижнечелюстные суставы и продающиеся в США.
У этих компаний будет 30 дней на то, чтобы представить план исследований, который должно будет утвердить FDA перед началом каких-либо послепродажных исследований.
В ходе исследований должны быть получены ответы на несколько важных вопросов. Среди них:
- Срок службы импланта от его установки до удаления или замены.
- Связь между диагнозом пациента и продолжительностью службы импланта.
- Срок службы следующего импланта между его установкой и удалением или заменой.
- Причины удаления или замены импланта.
- Связи между демографическими и клиническими данными о пациенте и необходимостью удаления импланта.
- Исследование имплантов, снятых с пациентов.
Проводя данное исследование, FDA рассмотрит вопрос внесения изменений в маркировку, введения требований о дополнительных предклинических и клинических исследованиях или иных регуляторных мер, которые могут оказаться необходимыми при одобрении данных устройств.